Ignacio Mártil
Catedrático de Electrónica de la Universidad Complutense de Madrid y miembro de la Real Sociedad Española de Física
1. Una breve introducción
El silicio es un semiconductor, una clase de materiales cuyas propiedades eléctricas difieren de las de los metales y de los aislantes. Una singularidad, entre otras, de los semiconductores es que sus propiedades pueden modificarse drásticamente incorporando átomos de otros elementos químicos en proporciones muy reducidas. El lector interesado en conocer más detalles de las propiedades de estos materiales puede consultar este artículo.
Con silicio se fabrican los circuitos integrados que hacen funcionar los equipos electrónicos que están presentes en nuestra vida cotidiana vinculados a las tecnologías de la Información y las Comunicaciones: los ordenadores, los teléfonos móviles, Internet....También son de silicio más del 90% de las células solares que hay instalados en los paneles y huertos solares que crecen sin cesar en todo el mundo y que ya constituyen una nueva y verdadera revolución verde en el campo energético [1]. El economista Jeremy Rifkin considera que la fusión de las tecnologías de las comunicaciones con las energías renovables esta dando lugar a una nueva y potente "Tercera Revolución Industrial"
El silicio se encuentra de forma natural en la arena. Cuando usted pasea por una playa o por el monte, está pisando silicio en unas cantidades muy apreciables, tal y como muestra la siguiente figura, que detalla la composición química de la corteza terrestre:

Composición química de la corteza terrestre, expresando la presencia de los principales elementos en porcentaje sobre el total
El silicio es el segundo elemento más abundante en al corteza terrestre, después del oxígeno. Ahora bien, el silicio que se utiliza en los circuitos integrados y en las células solares es extraordinariamente puro, pero en la naturaleza está mezclado con otros elementos químicos que lo hacen inviable para esas aplicaciones.
En este artículo describiré el proceso de purificación y obtención posterior de cristales adecuados para la industria microelectrónica (en lo que sigue ImE) y para la de fabricación de dispositivos fotovoltaicos (en lo que sigue IFV).
2. Purificación del silicio
El silicio se encuentra en la naturaleza combinado con oxígeno en forma de cuarcita que es en un 90% óxido de silicio, SiO2. El proceso de extracción de la cuarcita y su posterior purificación es laborioso y se realiza en varios pasos, en cada uno de los cuales se obtiene un silicio con un grado de pureza creciente.
Primer paso: obtención de silicio metalúrgico. Para ello, se separa del oxígeno mediante una reacción con carbono calentándolo a 1500-2000 ° C en un horno de arco eléctrico. Allí se somete a campos eléctricos muy elevados que rompen los enlaces químicos que unen al silicio con el oxígeno. La reacción química que se produce es la siguiente:
SiO2 + C → Si + CO2
El silicio resultante se denomina de grado metalúrgico y tiene una pureza del orden del 99%, con una importante contaminación de metales tales como Fe, Al, C, B, etc. Este silicio metalúrgico se produce a un bajo coste económico (3-5 €/kg) y a un coste energético moderado (~15 kWh/kg). En 2015 la producción total de silicio fue de 8,1 millones de toneladas. De esa cantidad, el 3% se destinó a la ImE y alrededor del 15% a la IFV.
El silicio metalúrgico se utiliza en la industria principalmente para la fabricación de metales, aleaciones de aluminio, etc., pero no vale para la ImE ni para la IFV, ya que en ambos casos, se requiere un grado de pureza mucho más elevado. En efecto, en el caso de la ImE, se requiere un silicio con un grado de pureza superior a 1 p.p.m. (una parte por millón) para cualquiera de sus impurezas habituales (C, Al, B, P, Fe, etc.); esto quiere decir que de cada millón de átomos de silicio, como mucho uno puede ser una de las impurezas no deseadas. Para el silicio destinado a la IFV, el requerimiento de pureza es algo menos estricto de 10 p.p.m. (como máximo, un átomo de impurezas por cada cien mil átomos de silicio). Por consiguiente, es preciso someter al silicio metalúrgico a procesos de purificación adicionales.
Segundo paso: obtención de silicio electrónico o de silicio solar. Se alcanza en dos nuevos pasos: en el primero, el silicio metalúrgico se convierte en gas en un proceso químico. Para ello, el silicio metalúrgico sólido se hace reaccionar con HCl a 300 ° C en un reactor para formar SiHCl3 mediante la reacción:
Si + 3HCl → SiHCl3 + H2
La clave del proceso es que durante la reacción, las impurezas del silicio tales como Fe, Al, y B reaccionan con el ClH formando haluros (FeCl3, AlCl3, y BCl3). Estos se pueden separar del silicio realizando un proceso de destilación fraccionada, que consiste en la separación sucesiva de los líquidos de la mezcla del SiHCl3 y los diversos haluros de impurezas, aprovechando la diferencia entre sus puntos de ebullición.
Finalmente, el SiHCl3 ya purificado se hace reaccionar con hidrógeno a 1100 ° C durante ~ 200 - 300 horas mediante la siguiente reacción:
SiHCl3 + H2 → Si + 3 HCl
El proceso tiene lugar en el interior de grandes cámaras de vacío, en las que el silicio se condensa y se deposita sobre barras de polisilicio para obtener sobre ellas el silicio ya purificado. La técnica fue desarrollada por primera vez por Siemens en la década de los 60 y se refiere a menudo como el proceso Siemens. La figura lo muestra:
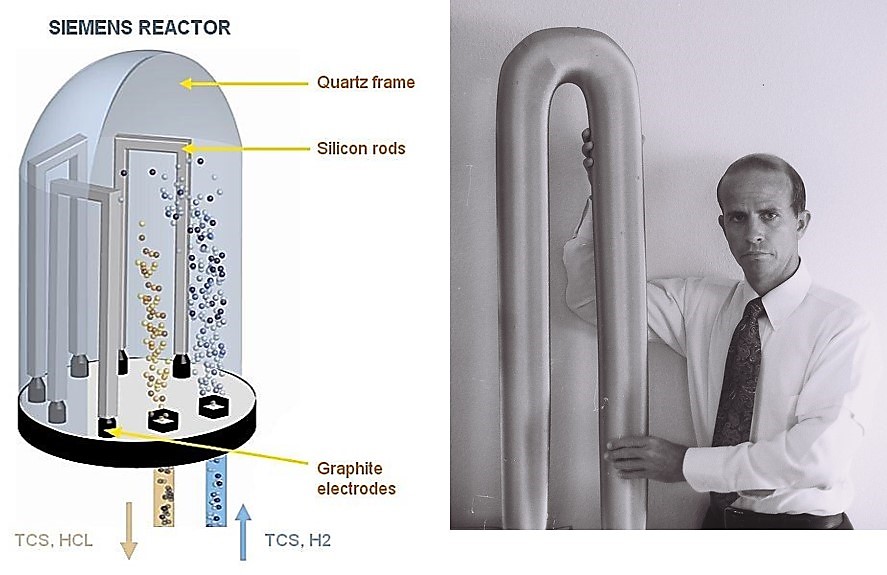
Izquierda: esquema de un horno Siemens; el SiHCl3 purificado entra en el reactor donde se deposita en las barras de silicio (silicon rods). Derecha: barras de silicio purificado que se obtienen al finalizar la condensación
El proceso Siemens es muy costoso en términos energéticos, ya que se consumen más de 100 kWh/kg Si, por lo que se han desarrollado procesos alternativos que requieren menos energía para obtenerlo.
Al final de la destilación, el SiHCl3 sigue teniendo impurezas, pero en una proporción bajísima, por debajo de 0,001 p.p.m. es decir, menos de un átomo de impureza por cada 1.000 millones de átomos de silicio. Este silicio ya es adecuado para la ImE y la IFV y las barras resultantes de silicio se muelen para obtener la materia prima del proceso de fabricación de obleas, que detallaré en el próximo punto.
Para algunas impurezas, como los metales de transición (Ti, V, Cr,...) el requerimiento es todavía más estricto, ya que es necesario que la presencia de dichos átomos este por debajo de 1 p.p.b. (una parte en un billón, menos de un átomo de metal por cada billón de átomos de silicio) [2]. Para ilustrar qué significa un grado de pureza tan elevado, imagine el lector el siguiente ejemplo: la superficie de EEUU, en números redondos, es de 10 millones de km2 (10 billones de metros cuadrados, 1013). Supongamos que se plantan pinos en toda esa superficie, a razón de uno por cada 10 m2, es decir, se plantarían en total un billón de pinos (1012). Supongamos también que entre las semillas de pino se "coló" inadvertidamente una semilla de roble, de manera que al final de la siembra, se plantaron un billón de pinos y un roble. Si aplicáramos a esta operación los requerimientos de pureza de la ImE, ¡esa plantación se debería considerar contaminada por robles!
3. Obtención del cristal de silicio
Una vez purificado el silicio, el siguiente paso es "ordenar" sus átomos formando una oblea (wafer) en la que los átomos de silicio se colocan en una estructura regular, formando un bloque con propiedades adecuadas para hacer sobre él los pasos necesarios para fabricar un circuito integrado o una célula solar. Esto se lleva a cabo mediante un procedimiento ideado en 1916 por un científico polaco, Jan Czorchalski. La figura ilustra esquemáticamente el método [3]:
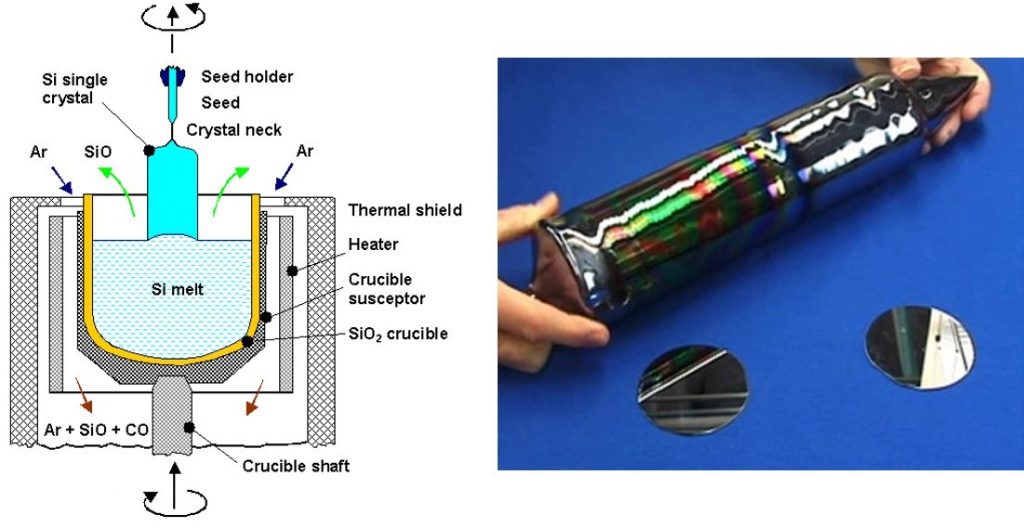
Izquierda: Esquema de un sistema Czorchalski de obtención de obleas de silicio. Derecha: lingote final y obleas una vez cortadas. Fuente: Universidad de Kiel, Alemania
Los detalles del proceso de obtención de la oblea de semiconductor son los siguientes:
i) El silicio purificado y molido se introduce en un crisol (SiO2 crucible) donde se calienta mediante el Heater y el Crucible susceptor hasta licuarlo (Si-melt).
ii) A continuación, la superficie del silicio líquido se pone en contacto con una pequeña semilla (seed) sujeta con una pértiga (seed holder). Esa semilla es un trozo de silicio de elevada calidad, cuya función es hacer de guía durante el proceso de obtención del cristal semiconductor.
iii) Posteriormente, la pértiga con la semilla fijada en su extremo se gira lentamente y se extrae del crisol, tal y como muestra la parte superior de la figura; en el proceso, los átomos de silicio se van situando en el bloque de semiconductor (Si single cristal) siguiendo la orientación marcada por la semilla. Durante el proceso de extracción, el silicio se enfría y solidifica.
iv) Finalmente, se obtiene un lingote (Si single cristal, se ve en la imagen de la derecha) de forma cilíndrica que se corta en "rebanadas" (wafers, obleas). Este silicio se denomina en la industria silicio CZ, por las primeras letras del apellido Czorchalski.
v) Las obleas se someten a diversos procesos adicionales que las dejan preparadas para fabricar en ellas un CI o una célula solar.
En el caso de la IFV, hay procesos que permiten obtener las obleas de forma más sencilla y económica que mediante el CZ descrito; en esencia son similares pero sin semilla que oriente el crecimiento; se obtiene así un multicristal (multi-Si), más imperfecto que el silicio CZ y como consecuencia, las células solares fabricadas con él son menos eficientes, pero notablemente más económicas.
3. ¿Tiene sustituto(s) el silicio?
La conjunción de abundancia y elevada madurez tecnológica ha hecho que el silicio ocupe un papel de casi monopolio en el campo de las aplicaciones de los semiconductores durante medio siglo. A mediados de los 80 se pensó en el GaAs como su sustituto en la ImE. El GaAs ha tenido un desarrollo industrial notable en campos tales como el radar, la electrónica de los aviones (aviónica), en dispositivos emisores de radiación como LEDs y Láser, etc., pero no ha substituido al silicio en la electrónica de gran consumo (electrodomésticos, teléfonos móviles, ordenadores,...). La industria de los chips de silicio facturó en 2015 alrededor de 300.000 M$, mientras que la de GaAs, no llegó a 7.000 M$, poco más del 2% de la primera.
Más recientemente, la aparición del grafeno ha generado numerosas expectativas, debido a sus propiedades excepcionales, superiores en muchos aspectos a las del silicio. No obstante, trasladar ese potencial a productos comerciales viables y competitivos en precio y prestaciones con los equivalentes del silicio está aún por demostrar. De manera que, a medio plazo, no se vislumbra una alternativa real a su dominio, aunque la ciencia del estado sólido avanza muy rápidamente y tal vez se diseñen procesos que puedan dan lugar a productos viables y competitivos en un plazo de pocos años; no obstante, hoy por hoy no dejan de ser meras especulaciones.
_____________
[1] El silicio es responsable de otra revolución, más antigua: la de las ventanas, los parabrisas, las botellas, etc. Todos ellos están hechos con sílice, la materia prima de la que se obtiene el silicio
[2] Cuando hablamos de billón, hay que tener cuidado; en Europa un billón es un millón de millones (1012); en EEUU un billón es 1.000 millones (109). En este artículo, utilizo la acepción europea.
[3] El lector interesado puede mirar este vídeo, que describe de manera gráfica y con cierto detalle el proceso de obtención del silicio con este procedimiento.
Comentarios
<% if(canWriteComments) { %> <% } %>Comentarios:
<% if(_.allKeys(comments).length > 0) { %> <% _.each(comments, function(comment) { %>-
<% if(comment.user.image) { %>
![<%= comment.user.username %>]() <% } else { %>
<%= comment.user.firstLetter %>
<% } %>
<% } else { %>
<%= comment.user.firstLetter %>
<% } %>
<%= comment.user.username %>
<%= comment.published %>
<%= comment.dateTime %>
<%= comment.text %>
Responder
<% if(_.allKeys(comment.children.models).length > 0) { %>
<% }); %>
<% } else { %>
- No hay comentarios para esta noticia.
<% } %>
Mostrar más comentarios<% _.each(comment.children.models, function(children) { %> <% children = children.toJSON() %>-
<% if(children.user.image) { %>
![<%= children.user.username %>]() <% } else { %>
<%= children.user.firstLetter %>
<% } %>
<% } else { %>
<%= children.user.firstLetter %>
<% } %>
<% if(children.parent.id != comment.id) { %>
en respuesta a <%= children.parent.username %>
<% } %>
<%= children.user.username %>
<%= children.published %>
<%= children.dateTime %>
<%= children.text %>
Responder
<% }); %>
<% } %> <% if(canWriteComments) { %> <% } %>